Chuyển hồ sơ vaccine Nanocovax sang Hội đồng Tư vấn cấp giấy đăng ký lưu hành
(DNTO) - Hội đồng Đạo đức trong nghiên cứu y sinh học quốc gia thống nhất sử dụng kết quả nghiên cứu thử nghiệm lâm sàng giai đoạn 3 của vaccine Nanocovax để chuyển đơn vị xem xét cấp giấy phép đăng ký lưu hành...
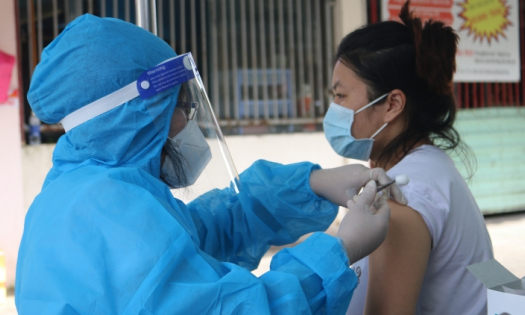
Chiều 18/9, Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia (Hội đồng Đạo đức) đã họp xem xét, đánh giá vaccine phòng Covid-19 Nanocovax.
Đây là lần thứ 2 hội đồng này họp đánh giá đối với vaccine Covid-19 đầu tiên của Việt Nam, hiện được thử nghiệm ở giai đoạn 3. Đại diện Hội đồng đạo đức trong nghiên cứu y sinh học Quốc gia cho biết sẽ sớm có thông tin báo chí chính thức về kết quả cuộc họp này.
Trước đó ngày 27/8, Hội đồng Đạo đức cho biết đã chấp thuận kết quả thử nghiệm lâm sàng giai đoạn 3a đối với vaccine Nanocovax.
Ngày 29/8, Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, đã họp và yêu cầu nhà sản xuất vaccine Nanocovax bổ sung thêm dữ liệu về hồ sơ chất lượng, hồ sơ dược lý, lâm sàng, tính sinh miễn dịch và hiệu quả bảo vệ.
Hiện toàn bộ hồ sơ, dữ liệu của vaccine Nanocovax đã được chuyển sang thường trực Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc, Hội đồng tư vấn, Bộ Y tế để tiếp tục xem xét trước khi trình Bộ Y tế đề xuất cấp phép khẩn cấp.
Trước đó, tại cuộc họp trực tuyến về rà soát, đẩy nhanh tiến độ triển khai nghiên cứu phát triển, thử nghiệm lâm sàng vaccine phòng, chống Covid-19 tại Việt Nam, Thứ trưởng Bộ Y tế Trần Văn Thuấn đề nghị nhóm nghiên cứu, nhà sản xuất vaccine Nanocovax tăng tốc, sớm nộp hồ sơ bổ sung gửi tới Hội đồng Đạo đức và Hội đồng tư vấn trình xem xét kết quả để đánh giá khả năng cấp phép cấp bách cho vaccine này.
Đến nay, ngoài Nanocovax, Việt Nam còn có 2 ứng viên vaccine Covid-19 khác đang triển khai thử nghiệm lâm sàng. Đó là vaccine Covivac do Việt Nam nghiên cứu, phát triển và vaccine ARCT-154 nhận chuyển giao công nghệ mRNA từ Mỹ.